近日,中國水產科學研究院黃海水產研究所海水養殖生物育種與可持續產出全國重點實驗室邵長偉研究員團隊通過創建工程化外泌體靶向遞送功能分子(miRNA)至魚體性腺,實現了對性別關鍵基因的精準調控。這是工程化外泌體在水產動物中的首次開發應用,將在水產動物基因功能精準調控及生殖干細胞靶向移植等領域發揮重要作用。研究成果以“Exosome Delivery to the Testes for dmrt1 Suppression: A Powerful Tool for Sex-Determining Gene Studies”為題發表于藥物遞送領域國際著名期刊Journal of Controlled Release(國際控制釋放學會的官方學術雜志)。
外泌體(Exosomes)是大多數細胞都能分泌的細胞外囊泡,直徑約100納米,因其具有免疫原性低、毒性低等優勢,使其成為極具潛力的功能分子和藥物遞送載體,然而目前其應用僅局限于人類等哺乳動物醫藥研究領域。邵長偉研究員團隊以半滑舌鰨為模型,以多種動物中較保守的性別關鍵基因dmrt1為調控對象,通過生物信息學與分子、細胞生物學實驗方法,成功構建了工程化外泌體,實現了dmrt1調控分子向半滑舌鰨精巢細胞的靶向遞送(圖1)。

圖1.工程化外泌體靶向遞送dmrt1調控分子
該工程化外泌體構建技術體系主要包括內含物的篩選、靶向肽的確定以及工程化外泌體的制備三部分。內含物的篩選是指通過TargetScan和miRanda預測以及雙熒光素酶、性腺細胞培養等實驗,篩選出能夠有效抑制dmrt1性別決定基因表達的miRNA。靶向肽的確定首先要通過半滑舌鰨精巢單細胞測序、全轉錄組測序等技術篩選出精巢Sertoli細胞膜高表達的受體FSHR,再通過Alphafold建立FSHR受體及其天然配體FSH的三維復合物結構,最終獲取結合域候選關鍵肽段(圖2)。工程化外泌體的制備則首先要通過差速超速離心方法提取卵巢細胞外泌體,并使用磷脂膜錨定技術將候選肽段加載到外泌體膜表面,再通過細胞和活體實驗分別驗證獲得高效靶向半滑舌鰨精巢的工程化外泌體(圖3)。最后通過活體注射方式,將該工程化外泌體應用于活體靶向抑制半滑舌鰨精巢dmrt1的表達,證實了dmrt1在維持精巢形態結構和促進精子發生過程中起到重要作用(圖4)。該技術體系的建立不僅實現了對性別相關基因功能的精準調控,還應用到了魚類生殖干細胞的靶向移植研究中,有望大幅提高生殖干細胞的移植效率,展示出了較強的應用潛力。
本研究是在該團隊首次證實魚類性別決定與分化的ceRNA調控機制、魚類性別發生的細胞學基礎等工作之后(Genome Research, 2022;Science China Life Sciences, 2022),在魚類性別決定與分化表觀遺傳領域取得的又一重要標志性成果。
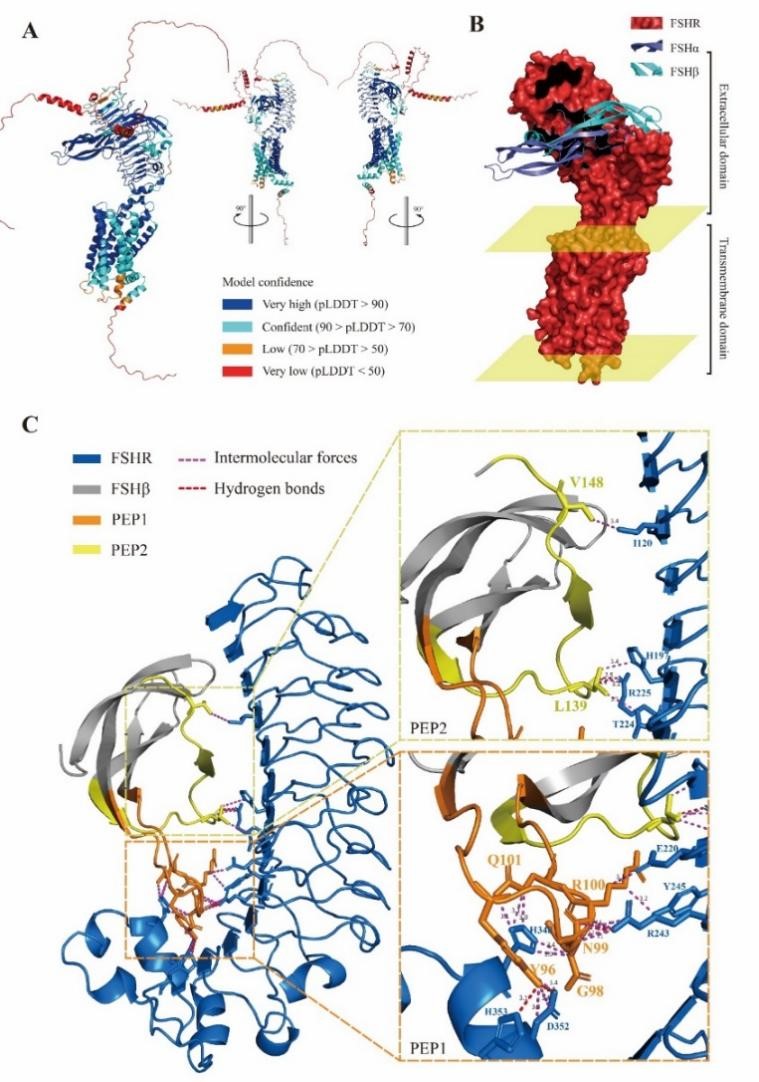
圖2.FSHR受體及其配基復合物結構

圖3.細胞和活體實驗證實PEP1修飾的外泌體具有更強的精巢靶向性

圖4.應用工程化外泌體實現半滑舌鰨精巢dmrt1的靶向抑制
黃海水產研究所博士后朱騰飛為論文第一作者,邵長偉研究員為論文通訊作者。本研究得到國家重點研發計劃、國家自然科學基金青年科學基金、山東省泰山學者青年專家、國家高層次人才特殊支持計劃、中央級公益性科研院所基本科研業務費專項資金、院創新團隊、青島市博士后應用研究項目等的大力支持。
原文鏈接:
https://www.sciencedirect.com/science/article/abs/pii/S0168365923006144?via%3Dihub

